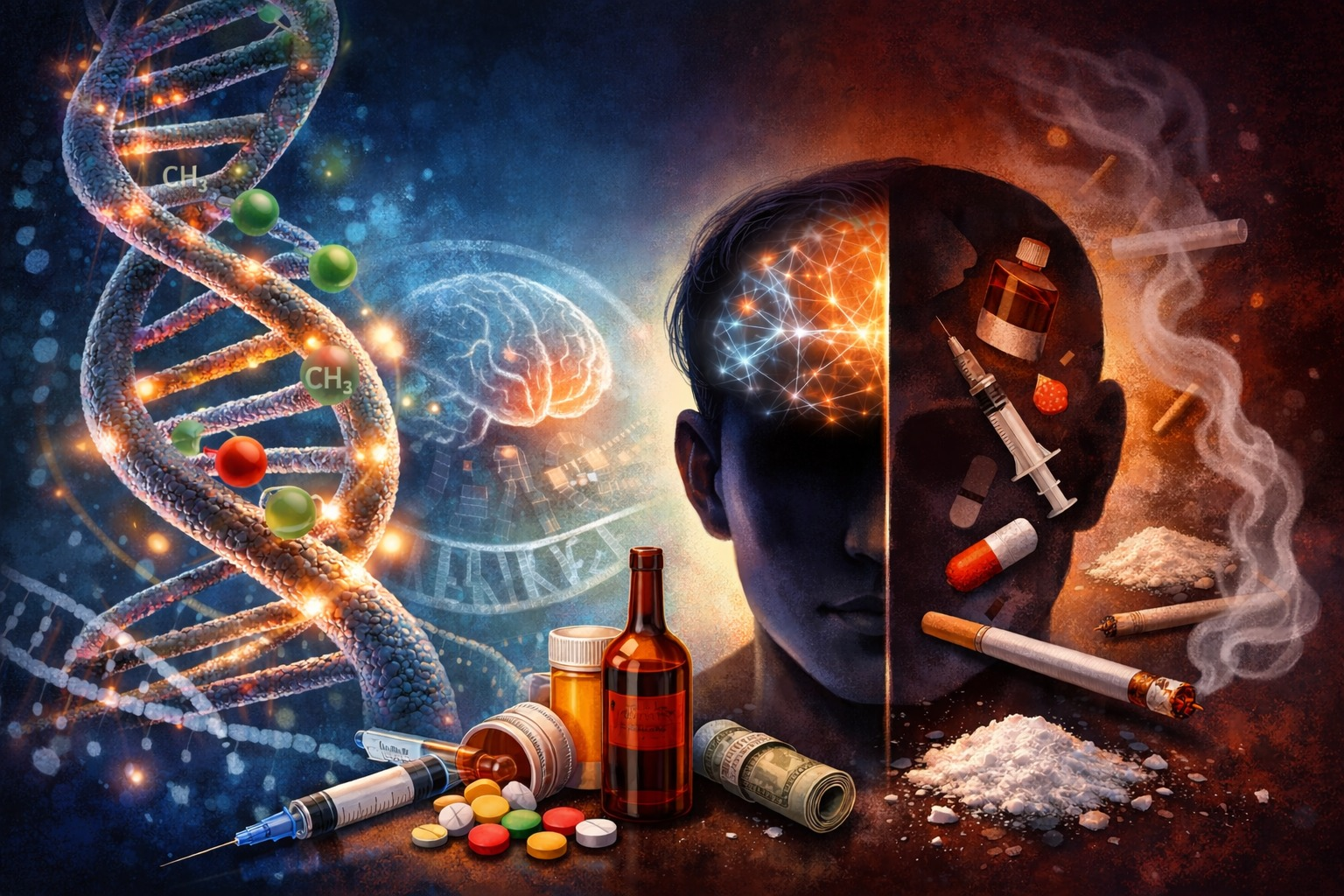
La epigenética regula procesos relacionados con el ADN mediante cambios en la cromatina, las principales modificaciones incluyen acetilación, metilación y fosforilación en las colas de las histonas, metilación del ADN y la generación de ARN no codificante. Éstas son dinámicas y reversibles, reguladas por enzimas “escritoras”, “borradoras” y “lectoras”. La diversidad y cantidad de sitios modificables en el ADN hacen que el estudio de la epigenética principalmente en la adicción sea altamente complejo.
El inicio de consumo de drogas puede considerarse multifactorial: influido por factores familiares donde el concepto de control parental toma relevancia, factores relativos a amistades, a factores personales y culturales tales como medios de publicidad, estilos de celebración de los acontecimientos importantes, competitividad, valoración del éxito rápido, ideas acerca de la convivencia familiar, uso adecuado del tiempo libre y tal vez a la filosofía de la vida actual.
Algunas evidencias sugieren que los factores ambientales como el consumo de drogas y sociales como por ejemplo el estrés, pueden alterar la expresión génica en el cerebro (y de otros órganos) en las personas consumidoras, provocando cambios en el desarrollo y el comportamiento en estos individuos, y probablemente facilitando la aparición de trastornos por uso de sustancias. Por tanto, comprender los mecanismos subyacentes a la interacción entre estos factores ambientales y genéticos es de importancia fundamental para determinar el desarrollo, la herencia y la posible mejora del tratamiento de la adicción a sustancias.
La adicción a las drogas no solo implica cambios en la conducta, sino también profundas modificaciones a nivel molecular en el cerebro, como cambios epigenéticos en las neuronas del circuito de recompensa que es una red de estructuras neuronales que genera placer y motiva comportamientos gratificantes que definen la adicción, pues regulan la expresión génica. Estas adaptaciones epigenéticas inducidas por drogas generan alteraciones en la función cerebral, por ejemplo: la acetilación de histonas H3 y H4 aumenta con el uso de cocaína, opiáceos, alcohol y nicotina, lo que facilita la activación transcripcional; también se han observado modificaciones epigenéticas tras la exposición a cannabinoides. Por ejemplo, hay un estado de metilación más elevado en el promotor del gen cnr1, que codifica el receptor de cannabinoides-1 (CB1R), en los sujetos con dependencia al Tetrahidrocannabinol (THC), en comparación con los de un grupo control. Esta alteración se correlacionó negativamente con la expresión de ARNm de CB1R, lo cual sugiere la participación de la metilación de cnr1 en la regulación de la dependencia a THC; dichos cambios son duraderos y contribuyen a la persistencia de comportamientos compulsivos, lo que convierte a la epigenética en un componente clave en la patogénesis de la adicción.
Cuando hay una exposición continua a sustancias, se altera el paisaje epigenético en regiones cerebrales clave, aunque distinguir cuáles de estas alteraciones son causales, en lugar de correlativas, ha sido un desafío. Para comprender la contribución causal de estas modificaciones, surge la neuroepigenética: una disciplina que emplea herramientas como CRISPR/dCas9 y proteínas de unión al ADN para editar marcas epigenéticas en loci específicos. Estas técnicas han demostrado que la regulación epigenética en genes como FosB y Cdk5 influye directamente en conductas adictivas, abriendo la puerta a terapias más precisas y con menos efectos secundarios. El principal reto sigue siendo la entrega eficiente de estas herramientas al cerebro, lo que actualmente se aborda mediante vectores virales. Otras herramientas son las manipulaciones experimentales de enzimas epigenéticas (HATs, HDACs, metiltransferasas) que alteran la respuesta conductual a drogas, indicando su papel en la patogénesis de la adicción.
La edición epigenética localizada permitirá identificar las modificaciones que impulsan la adicción y desarrollar terapias dirigidas. Combinada con modelos animales avanzados, podría ayudar a tratar aspectos críticos como el craving (deseo intenso y persistente de consumir algo, como una sustancia), la recaída y el consumo compulsivo. En el futuro, esta técnica permitirá identificar las adaptaciones que impulsan la adicción y diseñar tratamientos dirigidos, este enfoque promete revolucionar la comprensión y el manejo de los trastornos por uso de sustancias.
Referencias bibliográficas
Hamilton PJ, Nestler EJ. Epigenetics and Addiction. Curr Opin Neurobiol. 2019 December ; 59: 128–136. doi:10.1016/j.conb.2019.05.005.
Jara C, Acuña L. Adicciones y Epigenética Una reflexión enfocada a la Etapa de Adolescencia. PSIQUIATRÍA Y SALUD MENTAL. 2019. 3: 143-147.
Silva JP, Carvalho F. Drugs of abuse and epigenetics: Past, present and future. Adicciones. 2023; 35(3), 219-226.